Блестящая серия физических открытий в последнее десятилетие XIX века поистине явилась началом научной революции. Прологом к ней послужило открытие, сделанное в 1896 году французским физиком Антуаном Анри Беккерелем, который обнаружил, что соединения, содержащие атомы тяжелого металла урана, постоянно испускают какие-то неизвестные прежде лучи. Излучение имело такую проникающую способность, что засвечивало фотопленку, закрытую черной бумагой или даже металлической фольгой. Стали говорить, что урановые соединения радиоактивны, а само явление было названо радиоактивностью.
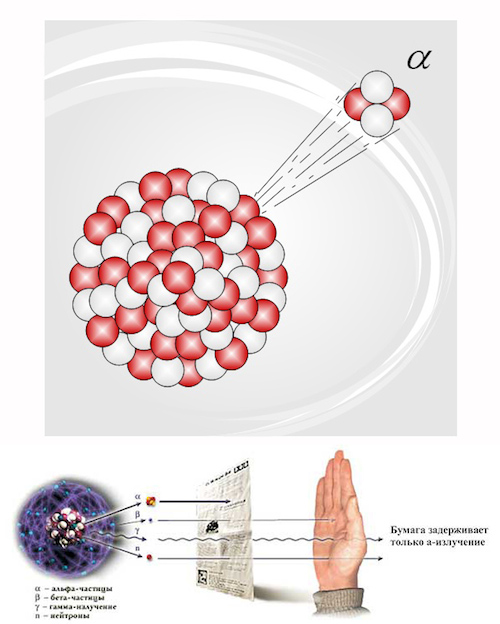
В следующее десятилетие ученые обнаружили, что излучение урана бывает трех видов. Лучи были названы по первым трем буквам греческого алфавита: α-лучи, β-лучи и γ-лучи.
Оказалось, что α -лучи состоят из частиц, масса которых примерно в 60 раз меньше массы атомов урана, из которых они вылетают, и почти равна массе легкого атома газа гелия. Действительно, доказано, что с α -частицы имеют очень близкое отношение к атомам гелия. β -лучи тоже состоят из частиц, но гораздо менее тяжелых, чем атомы. Их масса составляет только 1/1837 массы атома самого легкого вещества — водорода. Было обнаружено, что β -частицы очень похожи на другие легкие частицы, которые обнаружили в электрическом токе, проходящем через вакуум. Последние из-за своего происхождения были названы электронами.
Следовательно, β -частицу можно рассматривать как электрон, вылетающий из радиоактивного атома. γ -Лучи не являются частицами в прямом смысле этого слова. Они представляют излучение, обладающее, подобно свету, волновыми свойствами, с той только разницей, что γ -лучи имеют гораздо более короткие длины волн, чем свет.
Однако такое описание γ -лучей не является полным. Волновая природа γ -излучения удовлетворяла физиков XIX века, но в начале XX века на световые волны смотрели уже с новой точки зрения. В 1900 году немецкий физик Макс Планк после изучения закономерностей излучения нагретым телом световых волн различной длины обнаружил, что объяснить все явления радиации можно только в том случае, если энергия излучается маленькими порциями, которые он назвал квантами. Тело может излучать один квант света или два, но оно никогда не излучает полтора или два и одну треть кванта. Энергия излучается не непрерывно, а дискретно, отдельными порциями, или квантами. Однако кванты так малы, что в обычных условиях их нельзя различить, и энергия кажется непрерывным потоком. Подобно этому песчаный берег издали представляется сплошной широкой полосой и только на близком расстоянии в песке становятся заметными отдельные песчинки. Более глубокой аналогией является пример алюминиевого бруска, который даже под лучшим микроскопом кажется сплошным, НО который, как мы теперь шлем, состоит из отдельных мельчайших атомов.
Но не все кванты так малы. Величина квантов излучения зависит от длинны волны. Чем короче длина волны, тем больше кванты.
В некоторых случаях кванты ведут себя как частицы, поэтому они были названы фотонами (от греческого phos (pliolos)—свет). Естественно, чем больше кванты, тем ярче выражены корпускулярные свойства излучения. Обычный свет, обладая малыми квантами, слабо проявляет корпускулярные свойства, поэтому в XIX веке его принимали за чисто волновое явление. γ-Лучи, обладая большими квантами, проявляют корпускулярные свойства, которые нельзя игнорировать. Поэтому фотон γ-лучей относят к частицам, образующим субатомный мир.
Атомное ядро
Открытие α- и β-частиц заставило физиков изменить свои основные представления об атомах. В течение всего XIX века они считали атомы самыми мелкими частицами вещества. Предполагалось, что каждый отдельный элемент состоит из определенных атомов, отличающихся друг от друга только массой.
Масса отдельного атома исключительно мала. Чтобы получить один грамм массы, надо взять около трех миллиардов триллионов самых тяжелых из известных атомов. Чтобы не иметь дело с такими маленькими числами, химики предпочли приравнять массу атома кислорода произвольному числу 16 и относительно него измерять массу всех других атомов, или атомный вес. Число 16 было выбрано так, чтобы ни один атом, даже самый легкий, не имел по «кислородной шкале» атомный вес меньше единицы. По этой шкале атом водорода имеет атомный вес 1, атом гелия — 4, атом серы — 32, атом урана—238 и т. д.
Однако с открытием радиоактивности стало очевидным, что атом, каким бы ни были его свойства, не может быть просто очень маленьким бильярдным шариком, как его представляли химики XIX века. Он должен иметь структуру, должен состоять из еще меньших, субатомных частиц.
Масса β-частицы, как я уже говорил, в 1837 раз меньше массы самого легкого атома, тогда как весьма тяжелая α-частица гораздо меньше атома. Исчерпывающие эксперименты показали, что диаметр обычного атома порядка одной стомиллионной сантиметра. Диаметр α- частица намного меньше. Потребовалось бы около 50 тысяч частиц, уложенных одна к одной, чтобы они могли заполнить диаметр атома.
Решительный шаг в понимании внутреннего строения атома сделал английский физик, уроженец Новой Зеландии, Эренст Резерфорд. Он обстрелял тонкие металлические листки α-частицами и обнаружил, что они проходят через металл так, как будто на их пути ничего нет. Он сделал вывод, что атомы в основном «пусты». Но иногда α-частица как будто сталкивалась с чем-то твердым и отклонялась в сторону. К 1908 году Резерфорд пришел к заключению, что в состав каждого атома входит маленькое атомное ядро, расположенное в центре атома и занимающее не более одной триллионной его объема. Однако, несмотря на ничтожно малые размеры, на атомное ядро приходится 99,95% всей массы атома. Остальная часть атома занята электронами, имеющими такую малую массу, что для летящей α-частицы, масса которой более чем в 7000 раз превосходит массу одного электрона, она кажется пустой.
Все электроны, насколько нам известно, одинаковы. Тем или иным путем электроны можно выбить из атома. Каждый атом любого элемента содержит одно определенное число электронов.
При химических реакциях происходит передача одного или нескольких электронов от одного атома к другому. То, что обычно называют химической энергией, лучше было бы назвать «электронной энергией». Отдельный атом может иметь на один или несколько электронов больше или меньше, чем ему положено. В некоторых случаях атом вовсе не имеет электронов, так что остается только голое ядро. Например, атом гелия обычно имеет два электрона. Если оба электрона удалить, оставшееся голое ядро гелия будет идентично α-частице.
Несмотря на то что атомное ядро гораздо меньше атома, за исключением одного случая (атом водорода), оно не является бесструктурным. Все атомные ядра состоят из двух или более субатомных частиц, или нуклонов. Известны два типа таких частиц. Рассмотрим сначала эти две разновидности вместе, без различий.
Масса каждой из разновидностей нуклонов в атомных единицах немногим больше единицы. Примем массовое число нуклона равным единице, тогда масса данного атомного ядра в атомных единицах с несущественной на данном этапе погрешностью будет равна числу содержащихся в нем нуклонов. Более того, массу ядра можно приравнять равной массе атома, которому оно принадлежит.
Поскольку масса электрона равна 0,00054 массы нуклона, то вклад в массу атома пренебрежительно мал.
Ядра атомов некоторых элементов обладают характерным числом нуклонов. Например, все имеющиеся в природе атомы алюминия содержат в своих ядрах 27 нуклонов, следовательно, они имеют массовое число 27. Такие атомы принято обозначать «алюминий-27». Однако было обнаружено, что атомы большинства элементов отличаются числом нуклонов. Большинство ядер атомов водорода содержат один нуклон, но всегда есть очень невинное число атомов с ядрами из двух нуклонов. Следовательно, существуют водород-1 и водород-2. Аналогично в природе существуют гелий-3 и гелий-4 (α-частица есть, голое ядро атома гелия-4), уран-235 и уран-238. Атомы олова встречаются в десяти различных видах: оло-10-112, -114, -115, -116, -117, -118, -119, -120, -122, и -124. Правда, такое множество разновидностей одного элемента является совершенно исключительным.
Разновидности одного и того же элемента обычно на-1ынают изотопами. Водород, гелий и уран имеют по два изотопа каждый, олово — десять, алюминий — только один. Обычно химики обозначают элементы их химическими символами, состоящими, как правило, из одной или двух начальных букв названия элемента. Так, водород обозначается Н, гелий—Не, уран—U, алюминий—А1. Олово — один из немногих элементов, известных еще в древности, сохранило свое латинское название stannum, от которого происходит его химический символ Sn. Массовое число каждого изотопа пишется справа вверху химического символа. Так, водород-1 и водород-2 обычно записываются как Н1 и Н2. Аналогично можно записать Не3 и Не4, U235 и U238, Аl27, Sn112, Sn114 и все остальные.
| → > |
|---|









